2H2 + SO2 → 2H2O + S Phương trình phản ứng đã được cân bằng khi H2 tác dụng với SO2, trong chương trình học THPT có rất nhiều các phương trình hóa học khác nhau, để cân bằng được các phương trình hóa học thì các em cần nắm vững được tính chất của các chất cũng như điều kiện phản ứng khi xảy ra. Bài học này chúng tôi sẽ giới thiệu các bạn cách cân bằng phương trình H2 tác dụng với SO2 để tạo ra lưu huỳnh, Mời các bạn cùng theo dõi.
Tại đây :
Phương trình hóa học cân bằng :
2H2 + SO2 → 2H2O + S
Trong đó :
H2 là khí hidro không màu
SO2 là khí lưu hùynh dioxit không màu mùi hắc
H2O là nước lỏng không màu
S là sulfua chất rắn có màu vàng chanh
Điều kiện phản ứng để H2 (hidro) tác dụng SO2 (lưu hùynh dioxit) là gì ?
Nhiệt độ: Nhiệt độ.
Thực hiện thí nghiệm :
cho hiđro tác dụng với khí SO2 Xuất hiện kết tủa lưu huỳnh (S) màu vàng.
Đây là phương trình phản ứng oxi hóa khử
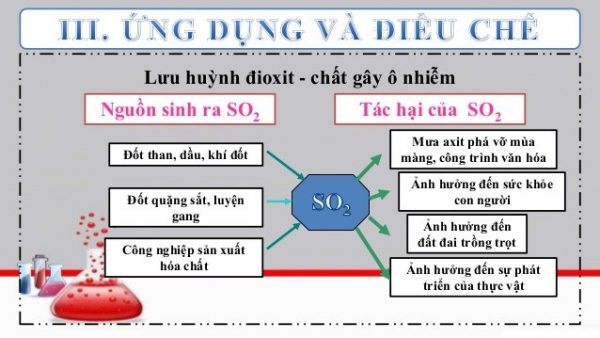
Ứng dụng của khí SO2 (lưu huỳnh điôxit) là gì?
So2 dùng để làm gì?
Lợi dụng những đặc tính kể trên, khí SO2 (axit sunfuro) có một số ứng dụng của so2 trong đời sống như:
Ứng dụng của so2 trong sản xuất axit sunfuric (H2SO4)
Nguyên liệu tẩy trắng: giấy, bột giấy, dung dịch đường…
Ứng dụng so2 dùng làm chất bảo quản cho các loại mứt quả sấy khô
Kháng khuẩn và chống oxy hóa trong sản xuất rượu vang